酸化発酵の生理学的研究とその産業利用
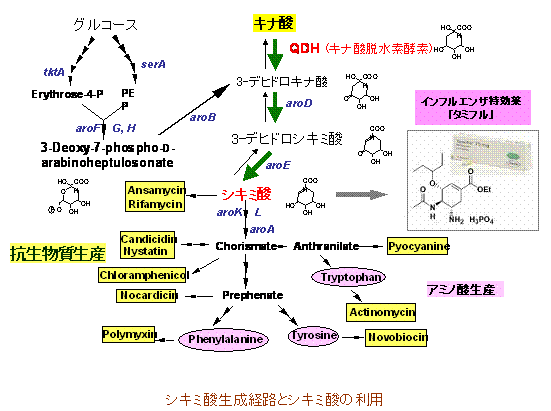
最近、特に5-ケトグルコン酸(5KGA)およびシキミ酸(SKA)生産系の研究に力点をおいて研究をすすめています。これらは、いずれもその用途が重要視されているにもかかわらず、大量生産が難しく社会問題にもなりつつある医薬素材です。5KGAはそれ自身有用な化学素材でありますが、酒石酸、キシリトール、ポリハイドロキシポリマーの合成中間体として注目され、多くの研究者が酢酸菌や関連微生物を用いた発酵生産を試みています。一方、多くの抗生物質だけでなく、タミフルの原料としても注目を集めているSKAは、樒(しきみ)の実からの抽出法や化学合成法によって現在供給されていますが、樒の深刻な品薄、さらに不斎点を3つも含んでいるSKAの化学合成の困難さのため、その大量供給は困難を極めています。5KGA生産については、海外のグループが酢酸菌の遺伝子工学的手法による発酵生産法を報告していますが、変異導入によって誘起される菌の生育障害が問題となっています。本研究で、長年にわたって展開してきた私たちの「酸化発酵の生理学」や「酸化発酵酵素の分子特性」の研究を基に、酢酸菌による5KGA生産を効果的に高めるアプローチをとっていて、他のグループの追随を許さない成果を得つつあります。一方、シキミ酸の生産については、現在、大腸菌にSKAを生産させる遺伝子工学技術も提案されています。このシステムは、初発物質であるグルコースから多段階の代謝経路を経由して合成されるため、低い変換効率が大量生産の大きな障害となっています。私たちは、グルコースに替わり、より直接的なキナ酸からの酸化発酵という効率的な変換系を用いて中間体を合成し、簡素な代謝系でSKAへ変換することをめざしています。つまり、酢酸菌細胞膜画分を直接キナ酸と反応させることにより高収率で中間体3-デヒドロシキミ酸(DSA)を生成し、さらにこのDSAをSKAへと転換するために、シキミ酸脱水素酵素(SKDH)ならびにNADPH再生系に必要なグルコース脱水素酵素(GDH)をそれぞれ酢酸菌細胞質から単離・精製し、DSAをそれらの精製酵素と反応に必要なNADPHを加え、過剰量のグルコース存在下で反応させる方法です。この方法で、ほぼ100%の転換率でSKAを生産できることが明らかになってきました。
これまでに種々の微生物から、様々な種類の菌体外多糖類の生産が報告され、食品添加物などに利用されています。これまで、種々の酢酸菌から、様々な種類の菌体外多糖の生産が報告されていますが、酢酸菌の培地表面への浮遊に関与する多糖に関しては、アセトバクター属酢酸菌の一種であるアセトバクター・キシリヌム(Gluconacetobacter xylinus)で報告されているだけでした。この菌は、菌体表面に付着した多糖としてセルロース(Cellulose)を生成することが知られています。私たちは、アセトバクター属酢酸菌が形成する菌膜はセルロースとはことなる新規な菌株によって異なる組成をもつヘテロ多糖であることを明らかにし、その精製法も確立してきました。例えば、アセトバクター・アセチの菌膜はグルコースとラムノースからなる多糖、アセトバクター・トロピカリスSKU100株の菌膜はグルコース・ラムノース及びガラクトースからなる多糖です。これら酢酸菌の菌膜を形成するヘテロ多糖は、免疫賦活化能を有することが期待され、医薬もしくは食品添加物としての利用の可能性が高い新規な多糖と考えています。特に酢酸菌は、食酢の生産に用いられてきた細菌であり、その食品としての安全性は数千年の経験的保証がなされていますので、食品での利用では非常に有利な性質をもつものと言えます。
<本研究課題に関連する研究業績(2000年以降)>
1)O. Adachi, Y. Fujii, Y. Ano, D. Moonmangmee, H. Toyama, E. Shinagawa, G. Theeragool, N. Lotong & K. Matsushita: Membrane-bound sugar alcohol dehydrogenase in acetic acid bacteria catalyzes L-ribulose formation and NAD-dependent ribitol dehydrogenase is independent of the oxidative fermentation; Biosci. Biotechnol. Biochem., 65, 115-125 (2001)
2)O. Adachi, Y. Fujii, M.F. Ghaly, H. Toyama, E. Shinagawa, & K. Matsushita: Membrane-bound quinoprotein D-arabitol dehydrogenase of Gluconobacter suboxydans IFO 3257: A versatile enzyme for the oxidative fermentation of various ketoses; Biosci. Biotechnol. Biochem., 65, 2755-2762 (2001)
3)D. Moonmangmee, Y. Fujii, H. Toyama, G. Theeragool, N. Lotong, K. Matsushita & O. Adachi: Purification and characterization of membrane-bound quinoprotein cyclic alcohol dehydrogenase from Gluconobacter frateurii CHM 9; Biosci. Biotechnol. Biochem., 65, 2763-2772 (2001)
4)E. Shinagawa, T. Fujishima, D. Moonmangmee, G. Theeragool, H. Toyama, K. Matsushita & O. Adachi: Purification and characterization of membrane-bound malate dehydrogenase from Acetobacter sp. SKU 14; Biosci. Biotechnol. Biochem., 66, 298-306 (2002)
5)D. Moonmangmee, O. Adachi, E. Shinagawa, H. Toyama, G. Theeragool, N. Lotong, & K. Matsushita: L-Erythrulose production by oxidative fermentation is calatalyzed by PQQ-containing membrane-bound dehydrogenase; Biosci. Biotechnol. Biochem., 66, 307-318 (2002)
6)S. Moonmangmee, H. Toyama, O. Adachi, G. Theeragool, N. Lotong, K. Matsushita: Purification and Characterization of a Novel Polysaccharide Involved in the Pellicle Produced by Thermotolerant Acetobacter Strain; Biosci. Biotechnol. Biochem., 65, 777-783 (2002)
7)K. Matsushita, Y. Fujii, Y. Ano, H. Toyama, M. Shinjoh, N. Tomiyama, T. Miyazaki, T. Sugisawa, T. Hoshsino, O. Adachi: 5-Keto-D-gluconate Production is Catalyzed by a Quinoprotein Glycerol Dehydrogenase, Major Polyol Dehydrogenase, in Gluconobacter sp. Appl. Environ. Microbiol., 69, 1959-1966 (2003)
8) O. Adachi, N. Yoshihara, S. Tanasupawat, H. Toyama, & K. Matsushita: Purification and Characterization of Membrane-bound Quinoprotein Quinate Dehydrogenase; Biosci. Biotechnol. Biochem., 67, 2115-2123 (2003)
9)O. Adachi, S. Tanasupawat, N. Yoshihara, H. Toyama, & K. Matsushita: 3-Dehydroquinate Production by Oxidative Fermentation and Further Conversion of 3-Dehydroquinate to the Intermediates in the Shikimate Pathway; Biosci. Biotechnol. Biochem., 67, 2124-2131 (2003)
10)D. Moonmangmee1 , O. Adachi, H. Toyama and K. Matsushita: d-Hexosaminate production by oxidative fermentation. Appl. Microbiol. Biotechnol. 66 (3), 253-258 (2004)
11)S. Vangnai, H. Toyama, W. De-eknamkul, N. Yoshihara, O. Adachi, K. Matsushita: Quinate oxidation in Gluconobacter oxydans IFO3244: purification and characterization of quinoprotein quinate dehydrogenase, FEMS Microbiol. Lett. 241, 157-162 (2004)
12) E. Shinagawa, H. Toyama, K. Matsushita, P. Tuitemwong, G Theeragool, and O. Adachi: A novel type of formaldehyde-oxidizing enzyme from the membrane of Acetobacter sp. SKU 14. Biosci. Biotechnol. Biochem. 70, 850-857 (2006)
13)O. Adachi, Y. Ano, H. Toyama, and K. Matsushita: High shikimate production from quinate with two enzymatic systems of acetic acid bacteria. Biosci. Biotechnol. Biochem., 70, 2579-2582 (2006)
14)O. Adachi, Y. Ano, H. Toyama, and K. Matsushita: Purification and characterization of NADP-dependent shikimate dehydrogenase from Gluconobacter oxydans IFO3244 and its application to enzymatic shikimate production. Biosci. Biotechnol. Biochem., 70, 2786-2789 (2006)
15)O. Adachi, Y. Ano, H. Toyama, and K. Matsushita: Enzymatic Preparation of metabolic intermediates, 3-dehydroquinate and 3-dehydroshikimate, in the shikimate pathway. Biosci. Biotechnol. Biochem., 70, 3081-3083 (2006)
<本研究課題に関連する科学研究費およびその他研究助成(2000年以降)>
・科研費・基盤 C:外山博英:グルコノバクター属酢酸菌のソルビトール代謝工学(平成18〜19年度)
・科研費・基盤 C:松下一信:酢酸菌キノプロテイン・グリセロール脱水素酵素と5-ケトグルコン酸生成(平成16〜17年度)
・DSM Nutritional Products AG ・共同研究:松下一信:Improvement of Oxidative Fermentations Using Gluconobacter Bacteria(平成18年4月1日〜20年3月31日)
・宇部興産・共同研究:松下一信:微生物が生産する多糖類利用技術(平成18年度)
・財団法人医薬資源研究振興会研究助成:松下一信:キナ酸を原料とするシキミ酸の高効率な新規製造法の開発(平成18年度)
・山口大学ベンチャービジネスラボラトリー(YU-VBL)研究支援:松下一信(代表);有用医薬素材である5-ケトグルコン酸及びシキミ酸高生産菌の開発(平成17〜18年度)
・野田産研研究助成:外山博英:5-ケトグルコン酸生成の安定な生産のための微生物生化学的研究(平成17年度)
・長瀬産業研究助成金:松下一信:Acetobacter 属酢酸菌の菌膜形成に関与する新規多糖の発見とその菌膜形成能制御に関する生化学的及び分子生物学的研究(平成14年4月〜15年3月)
・山口大学競争的教育研究重点化経費:松下一信:ポストゲノム対応型新規産業微生物学遺伝子機能を制御する微生物産業の新展開(14年度)