オキュラーサーフェス領域
角膜は眼球の最前面に位置する厚さ0.5mmの透明なドーム型の組織である。角膜が混濁したり,変形したりすることで視力が低下する。
【1】難治性角膜疾患に対する新しい角膜移植(Keratoplasty)術式の開発
当院では毎年80件前後の角膜移植を行っており、全国でも有数の手術数を誇る。通常の全層角膜移植術(PKP)、深層層状角膜移植術(DALK)、表層角膜移植術(LKP)、角膜内皮移植術(DSAEK)に加えて、独自に開発したDALK+三日月状DALK、PKP+周辺部部分的表層角膜移植(peripheral partial LKP)、PKP+周辺部部分的強角膜移植(peripheral partial SKP)などの術式も行っている。輪部機能不全のあるPKP眼の再移植時用には、中央のPKPグラフトと周辺部の表層グラフトをマニュアルでワンパーツに作成して行うマッシュルーム型全径全層角膜移植術を新たに開発した。また、疾患によっては強角膜移植、羊膜移植も施行している。さらに、難治性角膜疾患を伴う網膜剥離などの難治性網膜硝子体疾患に対して、従来行っていた人工角膜併用硝子体手術に加え、角膜移植、強角膜移植併用硝子体手術などを世界に先駆けて新たな術式として開発し、さらなる難治性疾患の治療への取り組みを行っている。
【2】感染性角膜炎(Infectious keratitis)に関する診断ツールの開発
感染性角膜炎の原因微生物は細菌、真菌、ウイルス、アメーバと多様である。原因微生物の同定のために、季節性のある感染症もあることから独自に感染性角膜炎カレンダーの作成を行い、さらに3ステップ式細菌性・真菌性角膜炎診断表などの独自のツールを開発している。
【3】角膜ジストロフィ(Corneal dystrophy)に対する遺伝子診断
当院では多くの角膜ジストロフィ患者の診療を行っており、確定診断のため遺伝子検査を行っている。顆粒状角膜ジストロフィ、格子状角膜ジストロフィ、膠様滴状角膜ジストロフィ、斑状角膜ジストロフィなどの遺伝子診断を行うことが可能である。
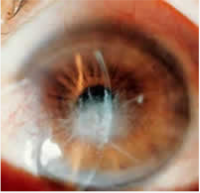
図1:世界で初めての報告した格子状角膜ジストロフィ(TGFBI遺伝子L527R)のホモ接合体の症例(Yamada N, et al. BJO 2005より転載)
【4】遷延性角膜上皮欠損(Persistent corneal epithelial defect)の治療法の開発
現状治療法がない難治性の遷延性角膜上皮欠損に対して、当教室では西田輝夫元教授の時代より、その分子機序の解明さらには新たな治療法の開発に取り組んできている。その成果として、遷延性角膜上皮欠損に対して新規ペプチド製剤を用いたFGLM-NH2+SSSR点眼、PHSRN点眼を開発し、実際に臨床応用を行い効果を得ている。
緑内障領域
【1】抗緑内障点眼薬による副作用の抑制
眼圧下降目的で一生涯に渡って行う緑内障治療薬物治療において、点眼薬のオキュラーサーフェスに対する影響、特に含有される防腐剤による角結膜上皮に及ぼす影響が問題となる。防腐剤による慢性炎症は、結膜下組織の瘢痕化を助長し、結膜に依存する緑内障濾過手術にとってマイナスである。
我々は、この防腐剤による副作用のメカニズムを解明し、副作用を抑制して健常な結膜組織の維持に寄与する新薬の開発に取り組んでいる。(図1)
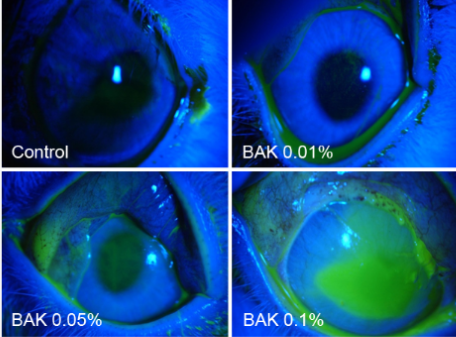
図1:塩化ベンザルコニウム点眼(BAK)によるウサギの角膜上皮障害
【2】緑内障手術成績向上に寄与する治療薬の開発
線維柱帯切除術は、房水を眼外に流出させ、結膜下に房水の濾過胞を形成することで眼圧下降効果を発揮する緑内障濾過手術の代表的な術式である。
その手術成績は、術後の結膜下線維組織であるテノン嚢組織の創傷治癒や炎症などの生体反応に影響されるために長期的には60-70%台に低下し、必ずしも良好ではない。
マイトマイシンCの術中使用は線維柱帯切除術の成績を向上させたが、一方で脆弱な濾過胞形成に起因する晩期感染症も問題も挙げられる。
したがって、我々は緑内障術後の創傷治癒をより積極的にコントロールする術後新規薬剤を開発し、手術成績および安全性を向上させたいと考えている。(図2,3)
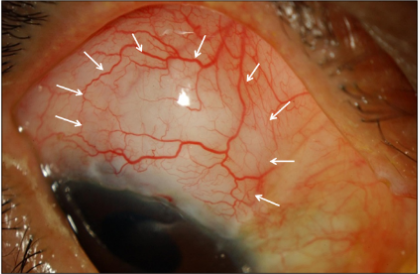
図2:線維柱帯切除術後の濾過胞
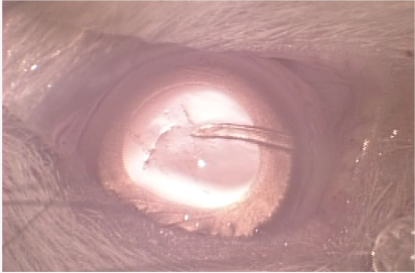
図3:ラットの緑内障濾過手術モデル(前房内チューブ挿入後)
【3】緑内障画像診断に対応する新しい視野測定プログラムや解析方法の開発
近年、より進化した光干渉断層計(OCT)が、超早期緑内障の症例(preperimetric glaucoma)の画像診断に用いられている。
しかしながら、OCTで形態学的異常(視神経乳頭の形状変化や網膜神経線維層の菲薄化)が検出されても、視野検査では異常が検出されないという測定結果の不一致がみられる。形態学的異常は視野変化に先行すると当たり前のように考えられているが、早期視野変化の検出系が追いついていないことが形態と機能の不一致のひとつの原因と考えている。我々は超早期緑内障の画像診断に対応できる新しい視野測定プログラムや解析方法の研究に着手している。画像診断に対応する視野検査が可能になれば、緑内障超早期での確定診断が可能となり、より正確な視野障害進行評価に貢献できると考えている。(図4)

図4:緑内障の形態・機能異常の解析(Forumu viewer®, Carl Zeiss Meditec)
網膜硝子体領域
【1】メカノストレスによる過剰な血管新生への影響
初期の加齢黄斑変性(AMD)において、網膜色素上皮細胞(RPE)の基部にドルーゼンなどが蓄積することがあり、AMDの進行と関連していると考えられている。ドルーゼンが形成された周囲のRPEは、膨張したドルーゼンにより引き延ばされ、メカノストレスを受けると考えられている(図1)。しかし眼科領域におけるメカノストレスの知見は乏しく、影響の詳細やその分子メカニズムなどは明らかにされてこなかった。
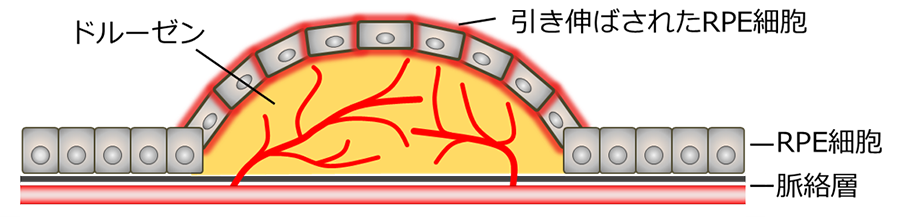
図1:RPE細胞への伸展刺激がAMDの増悪を誘導する概念図
我々は、RPEに対するメカノストレスが血管新生を誘導させることを明らかにし、このことはメカノストレスがAMDを増悪させることを示唆する。メカノストレスを受けたRPE1細胞では、メカノセンサーであるSRCが細胞質内で増加し、リン酸化p38が増加する。p38により安定化されたHIF-1αは、血管新生因子であるVEGFを増加させる。このような分子メカニズムがメカノストレスを受けたRPE1細胞で起こることで過剰に血管が新生される(図2)。このような機構がAMD増悪に関与していると考えられ、メカノストレスを制御することでAMDの治療に貢献できると考えられる。
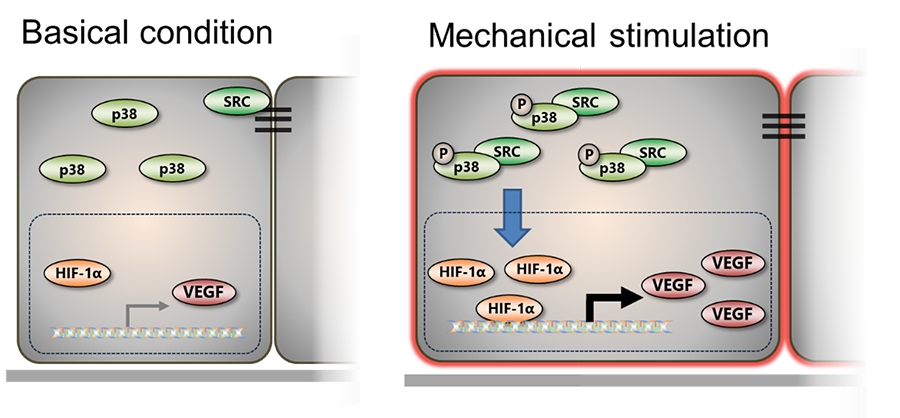
図2:メカノストレスが血管新生を誘導する分子メカニズム
【2】CLセンサー(ERG)の研究
Electroretinography(ERG・網膜電図)は、眼を機能評価するうえで最も重要な検査の1つであり、光を受容した網膜が発する電気信号を検出することで、網膜の状態を評価する。一般的な測定手法として、電極を眼又はまぶたに装着し、専用の検出器を装着してERGの測定を行う。このような手法は単回測定では問題がない一方で、経時的なモニタリング測定には適していない問題点があった。我々は、早稲田大学の三宅丈雄教授らの研究グループと共同で、市販コンタクトレンズに搭載可能なERG測定用電極を開発した(図3)。
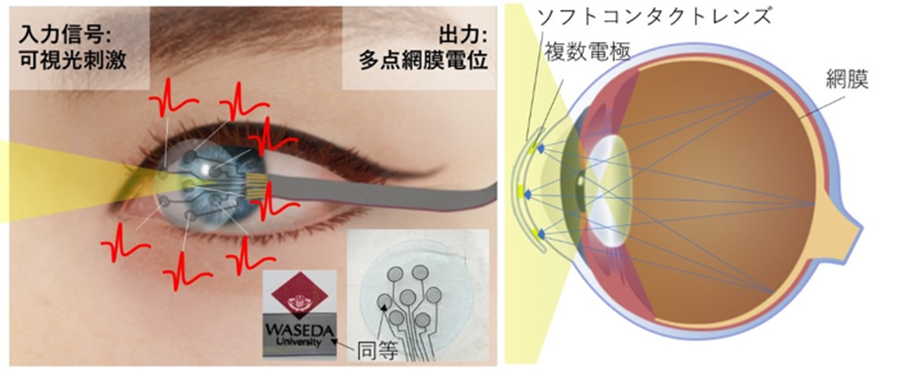
図3:透明で柔らかいマイクロ電極による多電極網膜電位計測システム
この技術によりERG測定のモニタリングが容易になり、網膜の異常をより正確に評価できることや、突発的なERGの変化を簡便に観察できることが期待される。
「透明度」「電気伝導度」「柔軟性」に優れる多点マイクロ電極搭載コンタクトレンズを開発
網膜の局所的応答測定に成功し緑内障や網膜色素変性症に伴う盲点評価へ期待
今後事業化に向けた臨床試験へ
https://www.yamaguchi-u.ac.jp/weekly/32218/index.html
【3】網膜色素上皮細胞の上皮間葉転換における転写とシグナル伝達の相関解析とそれに基づく創薬研究
加齢に伴う網膜組織の炎症は加齢黄斑変性を惹起させる。要因として炎症反応が誘起する網膜色素上皮細胞の上皮間葉転換 (EMT)が挙げられる。この結果、細胞間の接着が強固な上皮細胞が細胞間の相互作用が弱い間葉系細胞(筋線維芽細胞)へ形質転換し、筋線維芽細胞は脈絡膜へ浸潤しコラーゲン等の細胞外基質 (ECM) を過剰産生する。これにより線維増殖組織(瘢痕)が形成される。瘢痕の増強は視細胞死を起こし失明に至る。従って、網膜色素上皮細胞のEMTの分子機構解明は網膜変性疾患の病態解明に重要である。当研究室では図4に示した網膜色素上皮細胞のEMTにおけるシグナル伝達系と転写制御の相関を明らかにしている。
概要は以下である。サイトカイン刺激やECMからの剥離はp38MAPKの活性化を誘導し、転写補助因子CRP2の発現を増強する。CRP2はN末側で転写因子SRFとC側側でSRFの転写補助因子MRTFと結合し、CRP2BPとの相乗効果でSRF/MRTF複合体のSMC遺伝子(筋線維芽細胞で異所性に発現する平滑筋型α-アクチン [α-SMA]等をコードする遺伝子)のプロモーター領域に存在するSRFの結合配列(CArG-box)への親和性を高め、SMC遺伝子の転写を促進する。この結果、EMTが誘起され網膜色素上皮細胞が筋線維芽細胞へ形質転換する。これらの知見からp38MAPK及びCRP2が網膜変性疾患に向けた創薬ターゲットになることが示唆される。既に、CRP2の3次元構造解析からMRTFとの結合に関与する3次元空間と直接結合に寄与するアミノ酸残基を特定している。また、CRP2の発現を阻害し網膜色素上皮細胞のEMTを抑制する新規低分子化合物を見出している。これらの知見を基盤にして網膜変性疾患に向けた創薬研究を進めている。
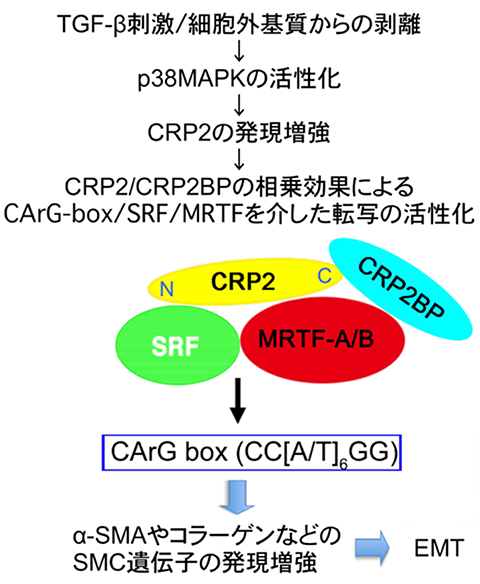
図4:網膜色素上皮細胞の上皮間葉転換 (EMT) におけるシグナル伝達系とCArG-box/SRFを介した転写制御との相関 (Hayashi et al. Cell Struct. Funct. 2023 48, 83-98, Hayashi et al. Cell Struct. Funct. 2023 48, 119-210)
【4】網膜下線維化の制御機構解明と治療
線維化とは、細胞外マトリクスの過剰な蓄積・沈着により、細胞本来の機能が損なわれる現象であり、網膜色素上皮細胞(RPE)の近傍で生じる網膜下線維化は、加齢黄斑変性(AMD)などの発症や進行に重要な影響を与える。RPEにおける上皮間葉転換(EMT)は、網膜下線維化の一因であると考えられており、我々はRPEにおけるEMTを理解・制御することによる網膜下線維化の抑制を目指している。これまでに我々は、コラーゲン三次元培養系や網膜下瘢痕形成モデルを用い、EMTによる網膜下線維化症の制御機構の一端を解明し、さらに、レチノイン酸受容体γ(RAR-γ)のアゴニストとされるR667が網膜下線維化進行に関与する因子の増加を抑制することを明らかにした。R667による、詳細な制御機構を解明することは、新しい網膜下線維化抑制の治療の確立につながると考えられる。R667に関しては、国内、国際特許を取得し、現在はフランスの製薬企業と共同研究を進めており、今後臨床研究を行う予定である。またこれまでに、RAR-γ以外の網膜下線維化制御関与を複数同定しており、これら因子の詳細な制御機構を解明することで、多角的な網膜下線維化の制御及び、治療法の確立を目指している。
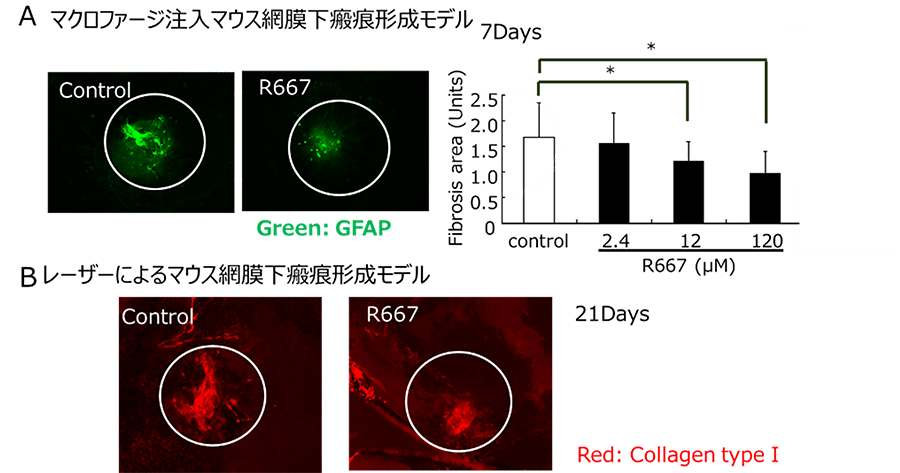
図5:網膜瘢痕形成モデルにおけるR667 による瘢痕形成抑制(Kimura K, et al. J Mol Med. 2015)
黄斑部疾患領域
【1】加齢黄斑変性における治療最小化レジメンの開発
新生血管型加齢黄斑変性(neovascular age-related macular degeneration; nAMD)では、網膜の中心である黄斑に新生血管を生じて視力や中心視野が障害される。本疾患への第一選択の治療は、新生血管の原因となる血管内皮増殖因子(vascular endothelial growth factor; VEGF)を抑制する物質、抗VEGF薬を眼球内に直接注入する抗新生血管療法(抗VEGF療法)だが、根治治療ではなく半数以上の患者で再発を繰り返し反復投与を要するため、患者への肉体的、精神的、経済的負担が問題視されている。
当院では、患者ひとりひとりの疾患活動性や再発性に応じて抗VEGF薬の投与レジメンを選択することで、投与を必要最小限とする投与レジメン(Trinity regimen)を考案した。本レジメンを用いた2年の治療経過では、再発傾向の少ない患者(グラフ内のPRN group)において、規定された間隔で投与を行う通常の投与レジメンと比較して、投与回数を3分の1近くに抑えることができ、視力維持も可能だった。
当科でのこのような個別化治療の取り組みは投薬による患者の負担軽減に繋がっており、現在はさらに長期的な治療経過における投与の低減、離脱の可能性について、各種画像検査や治療の法則性を基に検討を進めている。
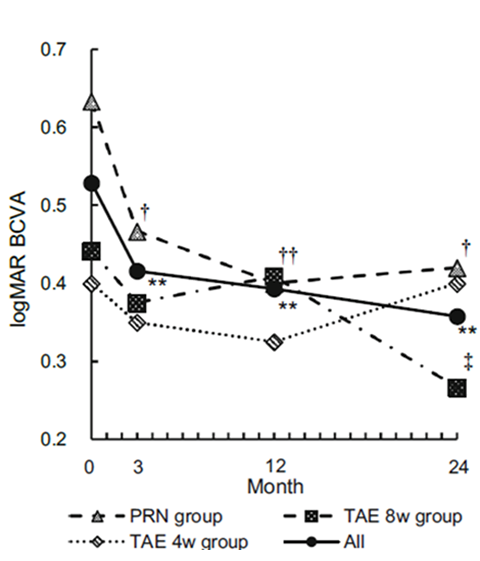
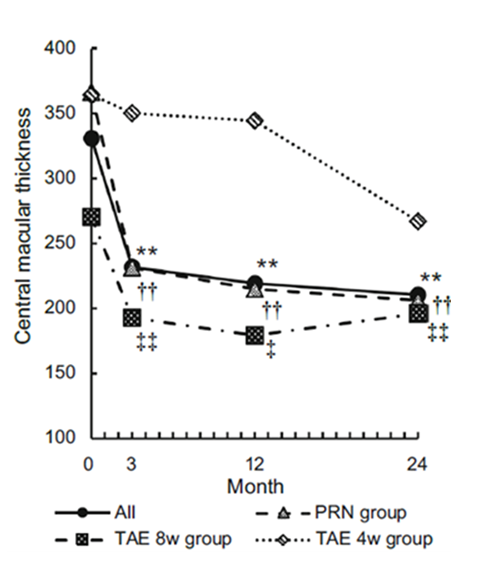
図1:Trinity regimenを用いた各投与グループでの視力(左グラフ・logMAR表記のため、縦軸の下ほど視力良好)および中心網膜厚(右グラフ)の経過
再発傾向の少ない患者(PRN group)では、2年間に5.3回の投与(通常のレジメンでは14回)で他の患者と同様に視力および中心網膜厚が改善し、2年間維持できた。
(Wakuta M, et al. Graefes Arch Clin Exp Ophthalmol. 2020 ;258(8):1663-1670. doi: 10.1007/s00417-020-04745-1.)
【2】網膜静脈閉塞症に対する最適な投与レジメンと血管安定化因子の探索的研究
網膜静脈閉塞症は、網膜血管の中でも静脈系に閉塞を生じ、網膜に出血や浮腫を来す疾患である。黄斑部に浮腫が及ぶと視力が低下するため、抗VEGF療法による速やかな浮腫の改善が必要となる。本疾患も加齢黄斑変性と同様に再発を生じるため、反復した抗VEGF薬の投与が必要となる。現在、AMDでの成果を基に本疾患の病態に即した投与レジメンを開発中であり、治療初期における抗VEGF療法への反応性と再発性に応じて最小限の投薬で十分な治療効果を得られる治療を目指している。また、長期的な疾患の沈静化には網膜血管の安定化が必要という観点から、治療中に採取された眼内液に含まれる各種サイトカインや免疫関連因子を解析し、画像検査の結果と総合して、疾患活動性や血管の安定化と関連する因子について解析を行っている。
【3】糖尿病黄斑症における治療抵抗例への効果的な投与レジメンの検証
糖尿病黄斑症は、糖尿病によって網膜の中心である黄斑部の血管が障害されることにより、黄斑部に浮腫(むくみ)を生じて視力低下や歪視、中心視野欠損を生じる疾患である。現在の主な治療は抗VEGF療法だが、治療に反応しない症例にはしばしば対応に苦慮し、従来から黄斑部局所レーザー等の併用療法が行われてきた。
当院では、未治療の糖尿病黄斑症症例に対して抗VEGF薬の導入期治療への反応性を確認し、黄斑部近傍に毛細血管瘤を有する反応不良例に対して局所レーザー併用療法の有効性を検証する多機関共同の特定臨床研究(RELAND試験、jRCTs061180035)を行った。結果としては、解析が可能だった94例中、抗VEGF薬の導入期治療への反応良好例が56例、反応不良例が14例であり、反応良好例(Responder group)では網膜浮腫は改善し良好な視力が維持できた。一方、反応不良例については局所レーザー併用の有無で抗VEGF薬の投与回数に差はなく、抗VEGF療法に抵抗性を示す症例において局所レーザーの併用で抗VEGF薬の減量は困難であること、必要な症例には十分な抗VEGF療法を行うことが視力を維持するために重要であることが示された。
(Hatano M, et al. Sci Rep. 2023;13(1):22965. doi: 10.1038/s41598-023-48665-6.)
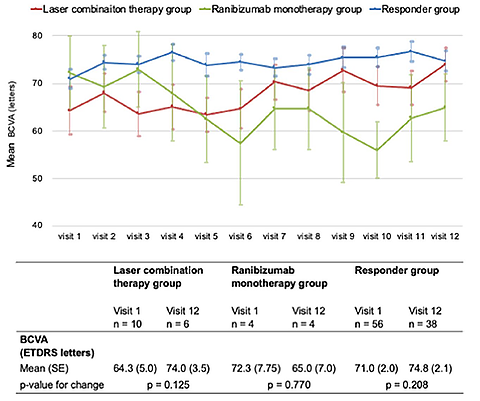
図2:糖尿病黄斑症に対する各治療群の視力経過
各群で治療開始時の視力が12か月目まで維持できた。